20. Describir el fenómeno de la radiactividad natural. Desintegración radiactiva. Emisión de partículas alfa, beta y gamma. Leyes de Soddy y Fajans. Ejemplos.
Temario de Selectividad de Fisica 2013
Introducción
En 1911 Rutherford demostró que el átomo esta compuesto por un núcleo y sus electrones girando a una distancia. En el núcleo existen dos tipos de nucleones, protones, con carga positiva, y neutrones, sin carga.
Los átomos se miden por varias magnitudes:
- Numero atómico: es el numero de protones que contiene (Z)
- Numero másico: es la suma de los nucleones, es decir, de los protones y de los neutrones (A)
- Numero de electrones ([math]\displaystyle{ N=A-Z }[/math])
Se denomina nuclido al conjunto de núcleos iguales entre si, coincidentes en A y Z.
Se denomina isotopo a los átomos de un elemento en el que varían sus neutrones.
La masa y el volumen del núcleo son características peculiares de los mismos. Respecto al volumen, se consideran esféricos, cuyo radio depende del numero másico A. El volumen de dicha esfera ([math]\displaystyle{ \frac{4}{3}\pi r^3 }[/math]) también depende de A. Respecto a la masa, los núcleos se miden en unidades de masa atómica, dado que las unidades estándar son excesivas. La unidad de masa atómica es una doceava parte de la masa del carbono 12.
Estabilidad de los núcleos. Energía de enlace
En el núcleo de los átomos, los nucleones se agrupan de tal modo que la distancia entre ellos es del orden de [math]\displaystyle{ 10^{-15} m }[/math]. A esta distancia tan pequeña, la fuerza eléctrica de repulsión entre los protones es muy grande y viene dada por la Ley de Coulomb.
La fuerza gravitatoria atractiva entre los mismos protones es despreciable frente a la fuerza eléctrica. En consecuencia, para que los núcleos sean estables, debe existir una tercera fuerza, muy intensa, de corto alcance y atractiva que supere las fuerzas eléctricas de repulsión y mantenga unido al núcleo.
Esta fuerza se denomina interacción nuclear fuerte. Es una fuerza que solo se manifiesta en el interior del núcleo y su valor parece ser el mismo, entre dos protones, dos neutrones o entre un protón y un neutrón.
Defecto de masa y energía de enlace
Al determinar con precisión las masas de los núcleos de los átomos, con un aparato denominado espectrógrafo de masas, se obtuvo un resultado sorprendente. El valor obtenido es siempre inferior a la suma de las masas de los nucleones que lo forman. Es decir, la masa real del núcleo es inferior a la suma de las masas de sus protones y neutrones. Esta diferencia se denomina defecto de masa y se calcula mediante la expresión [math]\displaystyle{ \Delta m = Z m_p + (A - Z)m_n - M }[/math], siendo [math]\displaystyle{ m_p }[/math] la masa del protón, [math]\displaystyle{ m_n }[/math] la masa del neutrón y M la masa del núcleo.
De acuerdo con la fórmula de Einstein, la energía equivalente a este defecto de masa es [math]\displaystyle{ E = \Delta mc^2 }[/math].
Esta energía se denomina energía de enlace o energía de ligadura del núcleo, y es la energía que se libera al formarse el núcleo a partir de los nucleones que lo constituyen. Coincide con la energía que hay que proporcionar al núcleo para separar los nucleones que lo forman.
Las energías de enlace de los núcleos son enormemente grandes. Para los núcleos estables está comprendida entre 2,2 MeV para el deuterio [math]\displaystyle{ _1^2 H }[/math] y 1640 MeV para el [math]\displaystyle{ _{83}^{209} Bi }[/math].
Un dato muy importante acerca de la estabilidad del núcleo es la energía de enlace por nucleón, que se obtiene dividiendo la energía de enlace del núcleo entre el número de nucleones que contiene. Cuanto mayor sea la energía de enlace por nucleón, más estable es el núcleo. El núcleo más estable es el del hierro-56, al que corresponde una energía de enlace por nucleón de 8,8 MeV/nucleón.
Si un núcleo pesado se divide en dos núcleos más ligeros (fisión nuclear), o si dos núcleos ligeros se unen para formar uno más pesado (fusión nuclear), se obtienen núcleos más estables, con mayor energía de enlace por nucleón, y se libera energía. Esta es la clave de la producción de energía en el Universo.
Radiactividad
La radiactividad fue descubierta por Henri Becquerel (1852-1908) en 1896, en un mineral de uranio.
Becquerel investigaba la luz emitida por algunas sustancias (fluorescencia), entre ellas el sulfato de potasio-uranio, después de iluminarlas con luz solar. Un día de febrero de 1896 no pudo disponer de luz solar por estar el día nublado y guardó en un cajón de su mesa La sal de uranio y una placa fotográfica protegida por un papel grueso de color negro, para continuar sus investigaciones cuando las condiciones meteorológicas fueran más favorables. Días más tarde comprobó que la película fotográfica estaba velada, y como no había estado expuesta a la luz solar, la única explicación lógica era que la sal de uranio emitía algún tipo de radiación invisible capaz de impresionar La placa fotográfica.
Más tarde comprobó que otros compuestos de uranio tenían el mismo comportamiento; por tanto, el uranio era el causante de estas radiaciones. Desde entonces, a esta radiación invisible y penetrante, capaz de velar las placas fotográficas, ionizar gases y atravesar cuerpos opacos, se le denomina radiactividad.
Dos años más tarde, los esposos Pierre y Marie Curie descubrieron el polonio y el radio, dos elementos también radiactivos. Nació así la Física Nuclear, es decir, la Física que estudia el comportamiento de los núcleos atómicos.
Las primeras experiencias con elementos radiactivos demostraron que las emisiones radiactivas no se veían afectadas por las reacciones químicas o por los cambios de presión y temperatura. La radiactividad debería ser, por tanto, producida por cambios en los núcleos de los átomos. Hay más de 250 núclidos estables, pero se conocen muchos más que son inestables. Los núcleos inestables se transforman espontáneamente en otros y emiten radiaciones.
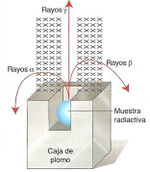
Cuando la radiación de una muestra se somete a la acción de un campo magnético, como en la Figura 13.6, se comprueba que existen tres tipos de radiaciones: radiación a, formada por partículas con carga positiva; radiación beta, formada por partículas con carga negativa, y otra radiación que no se ve afectada por el campo magnético puesto que no tiene carga eléctrica, denominada radiación gamma.
Radiación [math]\displaystyle{ \alpha }[/math]
Las partículas a son núcleos de helio, es decir, están formadas por dos protones y dos neutrones. Suelen emitirlas los núcleos demasiado grandes para ser estables, tales como los de uranio, torio, radio o plutonio.
La fuerza que mantiene unidos a los nucleones (interacción nuclear fuerte) actúa solo a distancias muy pequeñas, atrayendo solamente a los nucleones vecinos más cercanos. En los núcleos mayores que el [math]\displaystyle{ _{83}^{209} Bi }[/math], la repulsión eléctrica entre los protones hace inestable al núcleo y estos se transforman espontáneamente en núcleos más pequeños por emisión alpha. Por ejemplo: [math]\displaystyle{ _{88}^{226}Ra \rightarrow _{86}^{222} Rn + _2^4 He }[/math]
En esta reacción, como en todas Las reacciones nucleares, se conserva La carga total y el número total de nucleones. En efecto, el número de protones es el mismo en ambos miembros de la reacción (88 = 86 + 2), y Lo mismo ocurre con el número másico (226 = 222 + 4).
Debido a una masa relativamente elevada, a su carga eléctrica y a que son emitidas a velocidades no muy altas, las partículas alpha tienen un poder de penetración pequeño. Son detenidas por una lámina de cartón o unos pocos centímetros de aire; no son capaces de atravesar la piel de nuestro cuerpo.
Radiación [math]\displaystyle{ \beta }[/math]
La radiación beta está formada por electrones. Pero ¿cómo pueden surgir electrones del núcleo? En los núcleos pequeños el número de protones y de neutrones es casi el mismo y son estables, pero los núcleos más grandes tienen más neutrones que protones. Cuando la relación neutrones/protones es demasiado grande, el núcleo es inestable, porque la interacción nuclear fuerte es una fuerza de muy corto alcance, y se estabiliza convirtiendo un neutrón en un protón, un electrón y una partícula, sin carga y sin masa en reposo, llamada antineutrino [math]\displaystyle{ \vec v_e }[/math]:
[math]\displaystyle{ _0^1 n \rightarrow _1^1 p + _0^{-1} e + \vec v_e }[/math] ; [math]\displaystyle{ _{14}^6 C \rightarrow _{14}^7 N + _0^{-1} e + \vec v_e }[/math]
Las partículas beta se emiten con velocidades próximas a las de la luz; su masa es mucho menor que la de las partículas alpha y, por tanto, tienen un poder de penetración mayor. Son frenadas por unos metros de aire, una lámina de aluminio o unos centímetros de agua. La emisión beta se debe a la existencia de una fuerza nuclear denominada interacción nuclear débil. Su alcance es aún más corto que la interacción nuclear fuerte y su magnitud es, aproximadamente, [math]\displaystyle{ 10^{13} }[/math] veces menor.
Radiación [math]\displaystyle{ \gamma }[/math]
Los rayos gamma son ondas electromagnéticas con frecuencias muy altas, superiores a las de los rayos X. Se emiten cuando un núcleo que se encuentra excitado vuelve a su estado fundamental (de menor energía), al igual que ocurre en el átomo con los electrones excitados. La emisión gamma acompaña generalmente a las emisiones alfa y beta.
Los rayos gamma tienen un poder de penetración muy superior al de las radiaciones alfa y beta. Atraviesan el cuerpo humano y solo se frenan con planchas de plomo y muros gruesos de hormigón. Los cambios experimentados por Los números atómicos y Los números másicos de los núcleos que experimentan desintegraciones radiactivas se resumen en las leyes que fueron enunciadas por Soddy y Fajans, y se conocen como leyes de los desplazamientos radiactivos.
Leyes de los desplazamientos radiactivos
- Cuando en una transformación radiactiva se emite una partícula alfa, se obtiene un núcleo cuyo número atómico es dos unidades menor y su número másico es cuatro unidades menor.
- Cuando en una transformación radiactiva se emite una partícula beta, se obtiene un núcleo cuyo número atómico es una unidad mayor y no varía su número másico.
- Cuando un núcleo que se encuentra en un estado excitado vuelve a su estado fundamental (de menor energía), emite radiación gamma, pero no cambia su composición.
Magnitudes características de la desintegración radiactiva
En 1900, Rutherford sugirió que el ritmo con que una sustancia radiactiva emitía partículas radiactivas disminuía exponencialmente con el tiempo. Esto indica que los procesos radiactivos son aleatorios, que han de estudiarse estadísticamente, basando Las deducciones en el cálculo de probabilidades.
Puesto que la desintegración de un núcleo cualquiera se produce al azar, el número de núcleos que se desintegran, en un intervalo dt, es directamente proporcional al tiempo y al número de núcleos existentes.
Si N(t) es el número de núcleos radiactivos en un instante t y dN el número medio de desintegraciones en el tiempo dt, se cumple:
[math]\displaystyle{ -dN = \lambda Ndt }[/math] ; [math]\displaystyle{ \frac{dN}{N} =-\lambda dt }[/math]
donde [math]\displaystyle{ \lambda }[/math] es una constante de proporcionalidad, llamada constante de desintegración, que representa la probabilidad de que un determinado núcleo radiactivo se desintegre. Su unidad en el SI es el [math]\displaystyle{ s^{-1} }[/math]. El signo menos indica que el número de núcleos disminuye con el tiempo.
Al integrar la ecuación anterior, llamando [math]\displaystyle{ N_0 }[/math] al número de núcleos iniciales, resulta:
[math]\displaystyle{ L(\frac {N}{N_0})= -\lambda t }[/math]; [math]\displaystyle{ N = N_0 e^{-\lambda t} }[/math]
expresión que permite calcular el número de núcleos radiactivos que quedan sin desintegrar en cada instante, y es la ecuación fundamental de la radiactividad. También se puede expresar en función de la masa inicial de núcleos radiactivos m0 y de la masa existente m después de transcurrir un tiempo determinado:
[math]\displaystyle{ m=m_0 e^{-\lambda t} }[/math]
Se llama actividad o velocidad de desintegración A de una sustancia radiactiva al número de desintegraciones que se producen por unidad de tiempo:
[math]\displaystyle{ A= |\frac {dN}{dT}| = \lambda N }[/math]
La unidad de actividad en el SI es el becquerel (Bq), que equivale a una desintegración por segundo. Otra unidad muy utilizada es el curio (Ci), que se define como la actividad de una muestra de un gramo de radio, y equivale a [math]\displaystyle{ 3,7 \cdot 10^{10} }[/math] desintegraciones por segundo: [math]\displaystyle{ 1 Ci = 3,7 \cdot 10^{10} Bq }[/math].
La ecuación fundamental de la radiactividad también se puede expresar en función de la actividad inicial de una muestra radiactiva [math]\displaystyle{ A_0 }[/math] y la actividad de esa muestra A cuando ha transcurrido un determinado tiempo:
[math]\displaystyle{ A=A_0 e^{-\lambda t} }[/math]
Se denomina periodo de semidesintegración ([math]\displaystyle{ T_{1/2} }[/math]) o periodo de semivida al tiempo que debe transcurrir para que el número de núcleos presentes en una determinada muestra se reduzca a la mitad. Su cálculo se puede realizar haciendo [math]\displaystyle{ N = N_0/2 }[/math] en la ecuación fundamental:
[math]\displaystyle{ \frac {N_0}{2}=N_0 e^{-\lambda T_{1/2}} }[/math] y tomando logaritmos neperianos, resulta: [math]\displaystyle{ L2=\lambda T_{1/2} }[/math]; [math]\displaystyle{ {T_{1/2}} = \frac {L2} {\lambda} = \frac {0.693} {\lambda} }[/math]
Los tiempos de semidesintegración son muy diversos, desde billonésimas de segundo hasta miles de millones de años. En la Tabla 13.1 se reflejan los tiempos de semidesintegración de algunos núclidos radiactivos. Aunque en ocasiones se llama vida media al periodo de semidesintegración, parece más lógico considerar la vida media como el promedio de vida, es decir, el tiempo que por término medio tardará un núcleo en desintegrarse. En este caso, la vida media ([math]\displaystyle{ \tau }[/math]) es la inversa de la constante de desintegración:
[math]\displaystyle{ \tau= \frac{1}{\lambda} = \frac {T_{1/2}} {L2}= \frac {T_{1/2}} {0.693} }[/math]
El periodo de semidesintegración del yodo-131 es de 8 días aproximadamente.